COVID-19: após uma vacina estar pronta, o que falta para poder usá-la?
Saiba como funciona o processo de aprovação e distribuição de uma vacina para a COVID-19 no Brasil
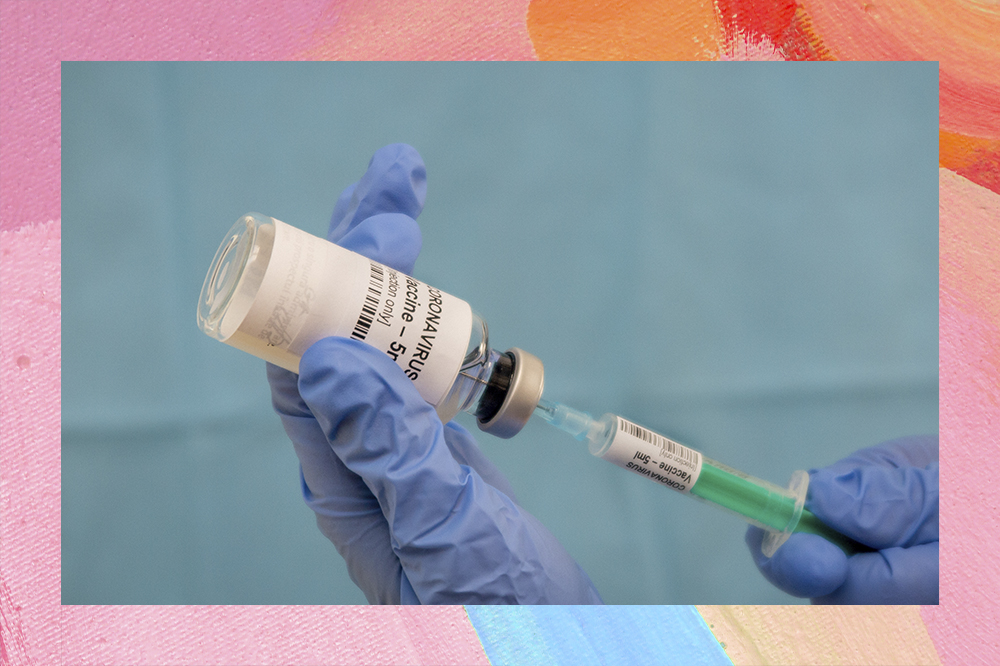
Depois do início da pandemia causada pela COVID-19, distanciamento e medidas redobradas de higiene entraram na rotina da população. Segundo os governantes, shows, eventos e aglomerações, como o Carnaval, devem voltar a ser realizados apenas quando uma vacina existir. No momento, mais de 140 delas na estão fase pré-clínica de testes e seis na terceira e última fase, apresentando resultados bastante motivadores: a vacina da farmacêutica Sinovac, a do Instituto Biológico de Wuhan com a Sinopharm, a da Universidade de Oxford em parceria com a AstraZeneca, a da Moderna, a da Pfizer e a do Instituto Biológico de Pequim com a Sinopharm.
No dia 11 de agosto, Vladimir Putin, presidente da Rússia, registrou a primeira vacina do mundo para a COVID-19, desenvolvida pelo Instituto Gamaleya, sediado em Moscou. Entretanto, segundo último levantamento da OMS, essa vacina ainda ainda estava na primeira fase de testes em julho. Apesar do registro, que significa que o país considera a substância segura, existem ressalvas e desconfianças por nenhum estudo clínico sobre ela ainda ter sido divulgado.
Mas e quando uma vacina estiver pronta? Qual será o próximo passo? A advogada Mérces da Silva Nunes, especialista em Direito Médico, explicou para a CAPRICHO o que deve acontecer depois que uma substância se mostrar eficaz.
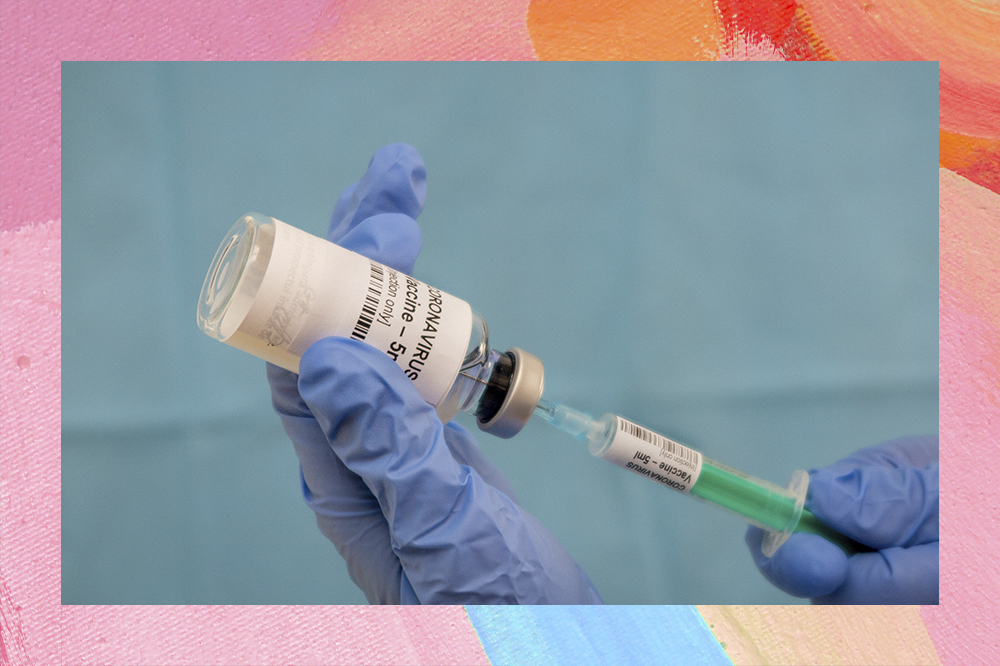
Após qualquer vacina se mostrar eficiente e segura, ela precisará ser aprovada pela Anvisa (Agência Nacional de Vigilância Sanitária) para ser usada em massa no Brasil. Apesar desse processo normalmente levar de 3 meses a um ano, a advogada explica que “a Anvisa baixou uma resolução dizendo que, se aparecer uma vacina eficaz para coronavírus, ela promete que o processo de registro vai ser feito em até 30 dias”.
Sobre o produto anunciado por Putin, Mérces diz que o registro na Rússia significa que a vacina pode ser aplicada lá, mas que não tem nenhuma importância jurídica para o mundo. “A Rússia não apresentou ainda os documentos que provam que a vacina é segura, eficaz e neutraliza o vírus” diz a especialista que afirma: apenas quando isso acontecer a vacina poderá ter alguma relevância.
Logo após a divulgação russa, o estado do Paraná assinou um acordo com o país que estabelece a “aproximação e início de parceria”. São Paulo também já garantiu a compra de lotes da vacina que está sendo desenvolvida pela farmacêutica chinesa Sinovac. Afinal, esses estados têm alguma prioridade?
De acordo com a advogada, teoricamente não. “Qualquer que seja a vacina que entrar no Brasil, ela vai receber o registro da Anvisa e vai fazer parte do Programa Nacional de Imunização, um programa federal organizado pelo Ministério da Saúde”, ou seja, quem decide a logística e a distribuição é a Vigilância Sanitária. Grupos de risco, como idosos e profissionais da saúde, devem ser priorizados e “pode ser que exista alguma preferência por um estado se ele for um local com foco grande de contágio, mas quem vai decidir isso é o Governo Federal”, explica.
Como estamos vivendo uma pandemia, a busca por uma vacina é um interesse global, assim como o desejo de garantir o acesso a ela. “Aqueles países que já adquiriram esses estoques vão ter prioridade na compra, como os Estados Unidos”, explica. Isso porque essas compras já foram realizadas. Mas Mérces acredita que, em um segundo momento, os estoques devem ser normalizar no mundo inteiro.
Para que países com uma economia mais delicada tenham a condição de ter a vacina, a Organização Mundial da Saúde está tentando estabelecer protocolos a fim de que aconteça uma distribuição gratuita ou a preço de custo. “A farmacêutica AstraZeneca já informou que a sua vacina será distribuída a preço de custo, isso significa algo em torno de 3,4, 5 dólares a dose”, explica Mérces.
#Vemvacina, nós estamos ansiosas!

 Esta regata branca que você já tem no armário vai ser a peça do verão
Esta regata branca que você já tem no armário vai ser a peça do verão Thais Braz curte Lollapalooza 15 dias após cirurgia na testa
Thais Braz curte Lollapalooza 15 dias após cirurgia na testa Imagens da 2ª temporada de ‘O Verão que Mudou Minha Vida’ são divulgadas
Imagens da 2ª temporada de ‘O Verão que Mudou Minha Vida’ são divulgadas




